Ácido ejemplos: 60 ácidos y bases comunes con sus fórmulas
El estudio de los ácidos y bases es fundamental en química, ya que son compuestos que presentan características y comportamientos opuestos que afectan no solo la naturaleza de las sustancias involucradas, sino que también influyen en una variedad de procesos químicos y biológicos. En este artículo, exploraremos ácido ejemplos y proporcionaremos una tabla de ácidos y bases para ilustrar las diversas sustancias que desempeñan un papel crucial en nuestras vidas y en la industria. Además, identificaremos las propiedades específicas, clasificación y reacciones comunes de estos compuestos.
Desde la acidez del limón hasta la alcalinidad del amoníaco, los tipos de ácidos y tipos de bases que encontramos son numerosos. Aprender sobre estos compuestos no solo nos ayuda a entender mejor la química del día a día, sino también a apreciar su importancia en la biología y en diversas aplicaciones industriales. Así que acompáñanos en esta exploración y descubramos álcalis ejemplos, alimentos ácidos ejemplos y más, en un recorrido que promete ser informativo y enriquecedor.
- Qué son los ácidos y bases
- Propiedades de los ácidos
- Propiedades de las bases
- Clasificación de ácidos y bases
- Ejemplos de ácidos comunes y sus fórmulas
- Ejemplos de bases comunes y sus fórmulas
- Ácido acético: el vinagre en tu cocina
- Ácido ascórbico: beneficios de la vitamina C
- Uso del clorhídrico en la industria
- Aplicaciones del sulfúrico en procesos químicos
- El papel del amoníaco como limpiador
- Importancia de los ácidos y bases en la biología
- Reacciones químicas comunes que implican ácidos y bases
- Cómo medir el pH y su relevancia
- Ácidos y bases en el hogar: precauciones y usos
- Conclusiones sobre la importancia de los ácidos y bases
- Referencias y recursos adicionales
Qué son los ácidos y bases
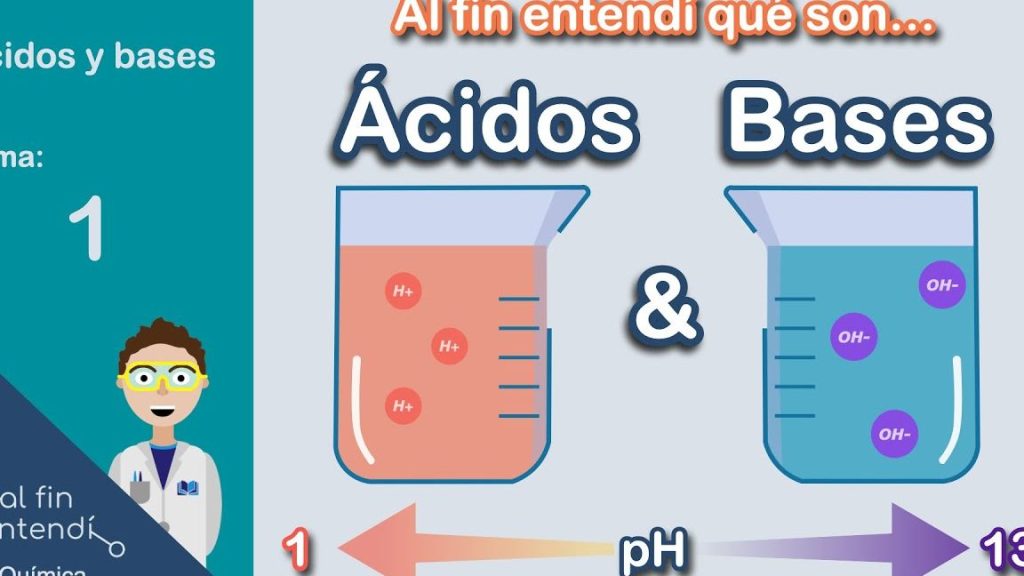
Los ácidos son compuestos químicos que se caracterizan por su capacidad de liberar protones (H+) cuando se disuelven en agua. Esta liberación de protones provoca que las soluciones acuosas tengan un pH menor a 7. Por otro lado, las bases son compuestos que pueden aceptar protones o liberar iones hidroxilo (OH-). Estos compuestos provocan que las soluciones acuosas tengan un pH mayor a 7. La comprensión de estas definiciones es crucial para comprender su comportamiento en diferentes entornos.
Propiedades de los ácidos
Los ácidos presentan varias propiedades físicas y químicas que los definen y que son útiles en diversas aplicaciones. A continuación, se enumeran algunas de sus características más destacadas:
- Sabor ácido: Muchos ácidos tienen un sabor característico, como el ácido cítrico en los cítricos.
- Corrosividad: Algunos ácidos, como el ácido clorhídrico y el ácido sulfúrico, son altamente corrosivos.
- Reacciones con metales: Los ácidos reaccionan con muchos metales para producir hidrógeno.
- Conductividad eléctrica: Los ácidos son electrolitos fuertes y pueden conducir electricidad en solución acuosa.
Propiedades de las bases
Las bases también tienen propiedades únicas que las distinguen. Aquí hay algunas de ellas:
- Sabor amargo: Muchas bases tienen un sabor amargo, como el bicarbonato de sodio.
- Resbalosidad: Las bases suelen tener una sensación resbaladiza al tacto, lo que las hace distintivas.
- Reacciones con ácidos: Las bases reaccionan con ácidos para formar agua y sal en un proceso llamado neutralización.
- Conductividad eléctrica: Al igual que los ácidos, las bases también son buenos conductores de electricidad cuando están disueltas en agua.
Clasificación de ácidos y bases
Los ácidos y las bases se pueden clasificar de varias formas. Una clasificación relevante es la que se basa en su fuerza, y aquí es donde entran los ácidos fuertes y ácidos débiles, así como bases fuertes y bases débiles.
Ácidos fuertes vs. ácidos débiles
Los ácidos fuertes son aquellos que se ionizan completamente en solución acuosa, liberando todos sus protones. Ejemplos de ácidos fuertes incluyen el ácido clorhídrico (HCl) y el ácido sulfúrico (H2SO4). Por otro lado, los ácidos débiles solo se ionizan parcialmente. Ejemplos de ácidos débiles son el ácido acético (CH3COOH) y el ácido fórmico (HCOOH).
Bases fuertes vs. bases débiles
Similar a los ácidos, las bases fuertes son aquellas que se ionizan completamente en agua, como el hidróxido de sodio (NaOH) y el hidróxido de potasio (KOH). En contraste, las bases débiles no se ionizan completamente, como el bicarbonato de sodio (NaHCO3) y la amina metilpropilamina (MPA).
Ejemplos de ácidos comunes y sus fórmulas
Ahora, procedemos a listar algunos ejemplos de ácidos comunes junto con sus fórmulas:
- Ácido clorhídrico (HCl)
- Ácido sulfúrico (H2SO4)
- Ácido nítrico (HNO3)
- Ácido acético (CH3COOH)
- Ácido ascórbico (C6H8O6)
- Ácido fosfórico (H3PO4)
- Ácido cítrico (C6H8O7)
- Ácido fórmico (HCOOH)
Ejemplos de bases comunes y sus fórmulas
Los siguientes son ejemplos de bases comunes y sus respectivas fórmulas:
- Hidróxido de sodio (NaOH)
- Hidróxido de potasio (KOH)
- Hidróxido de calcio (Ca(OH)2)
- Bicarbonato de sodio (NaHCO3)
- Anhidro amoníaco (NH3)
- Hidróxido de magnesio (Mg(OH)2)
- Hidróxido de litio (LiOH)
Ácido acético: el vinagre en tu cocina
El ácido acético (CH3COOH) es uno de los ácidos más comunes en el hogar y es el principal componente del vinagre, utilizado frecuentemente en la cocina. Este ácido no solo proporciona el sabor ácido característico de muchos platos, sino que también tiene aplicaciones en la preservación de alimentos y como ingrediente en aderezos. Además, el ácido acético tiene propiedades antimicrobianas, lo que lo hace útil para eliminar bacterias y hongos en diferentes superficies.
Ácido ascórbico: beneficios de la vitamina C
El ácido ascórbico (C6H8O6), más comúnmente conocido como vitamina C, es un ácido esencial para la salud humana. Como antioxidante, protege las células del daño causado por los radicales libres y juega un papel crucial en la producción de colágeno, una proteína que promueve la salud de la piel y los tejidos. El ácido ascórbico se encuentra comúnmente en frutas cítricas, fresas y kiwi, y su inclusión en la dieta ayuda a prevenir enfermedades y promover un sistema inmunológico fuerte.
Uso del clorhídrico en la industria
El ácido clorhídrico (HCl) es un ácido fuerte que tiene múltiples aplicaciones industriales. Se utiliza en la producción de cloruros, en el refinado de metales, en la producción de productos químicos y en el tratamiento de aguas. Su capacidad para descomponer minerales y metales lo convierte en un reactivo valioso en la industria petroquímica, donde se usa para tratar fracciones crudas de petróleo.
Aplicaciones del sulfúrico en procesos químicos
El ácido sulfúrico (H2SO4) es uno de los ácidos más relevantes en la química industrial. Se utiliza en la fabricación de fertilizantes, en la obtención de detergentes, en el refinado de petróleo y en la producción de productos químicos inorgánicos. Este ácido es extremadamente corrosivo y debe ser manejado con cuidado, pero es esencial para numerosos procesos industriales debido a su capacidad para deshidratar y descomponer compuestos orgánicos y minerales.
El papel del amoníaco como limpiador
El amoníaco (NH3) es una base común que se utiliza en muchos productos de limpieza del hogar. Su capacidad para disolver grasas, aceites y manchas lo convierte en un componente eficaz en limpiadores de vidrio, desengrasantes y productos para limpiar superficies. Sin embargo, es importante manejar el amoníaco con precaución, ya que puede ser tóxico en altas concentraciones y debe ser utilizado en áreas bien ventiladas.
Importancia de los ácidos y bases en la biología
Los ácidos y bases tienen un papel vital en los procesos biológicos. Por ejemplo, el ácido desoxirribonucleico (ADN) y el ácido ribonucleico (ARN) son fundamentales para la transmisión de información genética. Además, los procesos metabólicos a menudo involucran reacciones ácido-base que son cruciales para la producción de energía en las células. La regulación del pH en el cuerpo es esencial para mantener un entorno adecuado para las reacciones enzimáticas y las funciones celulares.
Reacciones químicas comunes que implican ácidos y bases
Las reacciones entre ácidos y bases son componentes clave en la química y se denominan reacciones de neutralización. Cuando un ácido se mezcla con una base, producen agua y un sal. Un ejemplo típico es la reacción entre el ácido clorhídrico (HCl) y el hidróxido de sodio (NaOH), que produce cloruro de sodio (sal de mesa) y agua:
HCl + NaOH → NaCl + H2OAdemás de esta reacción básica, existen muchas otras reacciones ácidas y básicas que ocurren en soluciones y son fundamentales en procesos industriales y biológicos.
Cómo medir el pH y su relevancia
El pH es una medida de la acidez o alcalinidad de una solución y se mide en una escala de 0 a 14. Un pH de 7 es considerado neutro, valores por debajo de 7 indican acidez y valores por encima de 7 indican basicidad. La medida de pH ejemplos es esencial en diversas aplicaciones, desde el tratamiento de aguas hasta la agricultura y el control de procesos industriales. Existen varios métodos para medir el pH, incluyendo tiras reactivas, medidores de pH y soluciones estándares que permiten ajustar y regular el pH en diferentes entornos.
Ácidos y bases en el hogar: precauciones y usos
En nuestro hogar, es común encontrarnos con productos que contienen ácidos y bases. Estos compuestos son útiles en la limpieza, la conservación de alimentos y la cocina. Sin embargo, es vital usarlos con precaución. Por ejemplo, mientras que el vinagre (ácido acético) es seguro de usar en alimentos, el ácido clorhídrico y el hidróxido de sodio requieren un manejo cuidadoso. Siempre es recomendable leer las etiquetas y seguir las instrucciones del fabricante para garantizar un uso seguro.
Conclusiones sobre la importancia de los ácidos y bases
La comprensión de los ácidos y bases es esencial para apreciar su influencia en nuestra vida diaria, procesos industriales y la biología. Desde el vinagre en nuestras mesas hasta el ácido sulfúrico en fábricas, estos compuestos desempeñan un papel vital en múltiples contextos. Al estudiar ácido ejemplos y sus aplicaciones, podemos expandir nuestro conocimiento sobre la química y las interacciones de estos compuestos en el mundo que nos rodea.
Referencias y recursos adicionales
Para obtener más información sobre tipos de ácidos, tipos de bases, pH y ejemplos, puede consultar las siguientes fuentes:
- Libros de texto de química general
- Páginas web educativas de química
- Artículos en revistas científicas
- Recursos en plataformas educativas en línea

Entradas relaciondas