Oxidación y reducción: Claves para entender sus diferencias
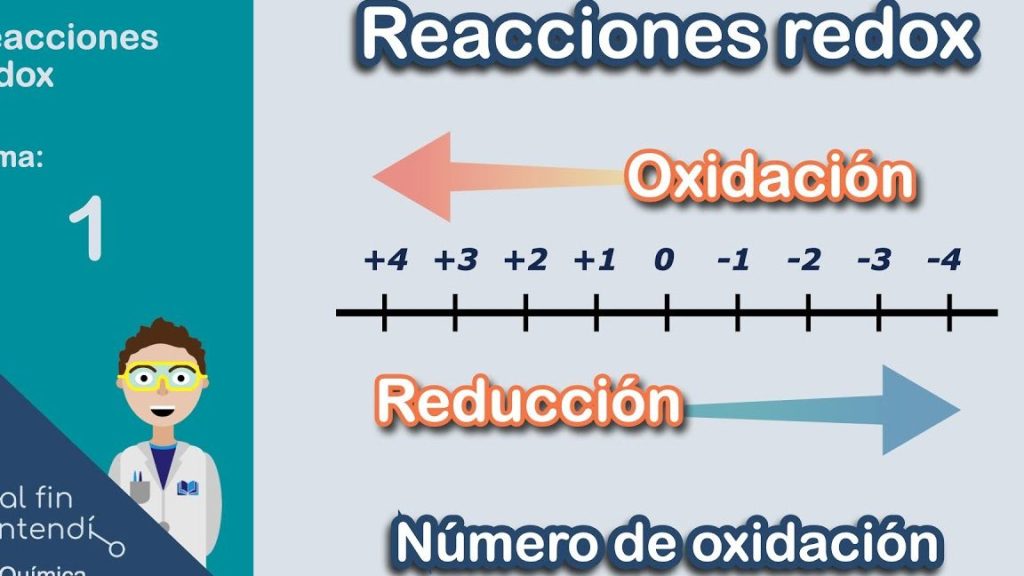
La oxidación y la reducción son procesos fundamentales en la química, indispensable para entender una amplia variedad de reacciones químicas que ocurren en nuestro entorno. Estos procesos son conocidos colectivamente como reacciones redox o oxidación-reducción. En esencia, la oxidación implica la pérdida de electrones, mientras que la reducción implica la ganancia de electrones. Esta interrelación entre oxidación y reducción no solo es importante en el ámbito académico, sino que también tiene aplicaciones prácticas en la industria y la vida cotidiana.
El entendimiento de las diferencias entre oxidación y reducción es crucial para la comprensión de fenómenos como la corrosión y la energía eléctrica. La oxidación puede llevar a la degradación de estructuras metálicas, mientras que la reducción es fundamental en procesos como la electroquímica. Por lo tanto, en este artículo nos proponemos explorar a fondo las definiciones, conceptos, reacciones y aplicaciones de la oxidación y reducción para facilitar una comprensión más clara y profunda de estas importantes transformaciones químicas.
- Oxidación: Definición y Conceptos Básicos
- Reducción: Definición y Conceptos Clave
- Reacciones Redox: La Interacción entre Oxidación y Reducción
- Ejemplos Comunes de Reacciones de Oxidación y Reducción
- Agentes Oxidantes y Reductores: ¿Quiénes Son?
- La Importancia de las Reacciones Redox en la Química
- Aplicaciones de la Oxidación y Reducción en la Vida Cotidiana
- Conclusión: Resumen de las Diferencias entre Oxidación y Reducción
Oxidación: Definición y Conceptos Básicos
La oxidación se define estrictamente como el proceso mediante el cual un átomo o ion pierde electrones, lo que resulta en un aumento en su estado de oxidación. Este fenómeno puede observarse en diferentes contextos, incluyendo la combustión, la respiración celular y en la corrosión de metales. En términos simples, si un elemento pasa de un estado de oxidación menor a uno mayor, está sufriendo una reacción de oxidación.
Ejemplos de Oxidación
Un ejemplo clásico de oxidación es la reacción del magnesio. Cuando el magnesio (Mg) se quema en presencia de oxígeno, se transforma en óxido de magnesio (MgO) y se oxidiza en el proceso al perder electrones:
2 Mg + O₂ → 2 MgO.En esta reacción, el magnesio pierde electrones para formar iones Mg²⁺, mostrando así el proceso de oxidación.
Reducción: Definición y Conceptos Clave
La reducción, como concepto opuesto a la oxidación, se define como el proceso mediante el cual un átomo o ion gana electrones, lo que resulta en un decremento de su estado de oxidación. Esto significa que, al pasar de un estado de oxidación mayor a uno menor, se está produciendo una reacción de reducción.
Ejemplos de Reducción
Un ejemplo habitual de reducción se puede observar en la conversión de iones de cobre (Cu²⁺) en cobre metálico (Cu) durante los procesos electrolíticos:
Cu²⁺ + 2e⁻ → Cu.En esta reacción, el ion de cobre gana electrones y su estado de oxidación baja de +2 a 0, lo que demuestra el proceso de reducción.
Reacciones Redox: La Interacción entre Oxidación y Reducción
Las reacciones redox son aquellas que involucran simultáneamente procesos de oxidación y reducción. En una típica reacción redox, un agente oxidante provoca la oxidación de otro sustancia, mientras que un agente reductor provoca la reducción. Esta dualidad es lo que permite que se produzcan estas reacciones químicas de cambio de electrones.
Ejemplo de una Reacción Redox
Un claro ejemplo de una reacción oxidación reducción es la reacción del hierro con oxígeno para formar óxido de hierro (óxido de hierro III):
4 Fe + 3 O₂ → 2 Fe₂O₃.En esta reacción, el hierro se oxida al perder electrones, y el oxígeno se reduce al ganar electrones, creando un balance perfecto entre ambos procesos.
Ejemplos Comunes de Reacciones de Oxidación y Reducción
Las reacciones de oxidación y reducción están presentes en diversas reacciones químicas cotidianas. Algunos ejemplos incluyen:
- Corrosión: El deterioro de metales debido a la oxidación, como el óxido de hierro que se forma en el óxido de un clavo.
- Combustión: Reacciones que incluyen la oxidación de combustibles, como la quema de hidrocarburos.
- Reacciones en baterías: En las baterías, hay reacciones redox que permiten generar energía eléctrica a través de la transformación de energía química.
Agentes Oxidantes y Reductores: ¿Quiénes Son?
Los agentes que participan en las reacciones oxidacion reduccion pueden clasificarse como agentes oxidantes y agentes reductores. Un agente oxidante es aquel que causa la oxidación de otra sustancia, mientras que un agente reductor causa la reducción.
Ejemplos de Agentes Oxidantes y Reductores
Los oxidantes ejemplos incluyen el oxígeno, el cloro y el permanganato de potasio, que son sustancia que pueden aceptar electrones y provocar la oxidación de otros compuestos. Por otro lado, los reductores ejemplos incluyen el hidrógeno, el zinc y el monóxido de carbono, que son capaces de donar electrones y provocar la reducción de otros elementos.
La Importancia de las Reacciones Redox en la Química
Las reacciones de oxidación y reducción son vitales para una comprensión adecuada de numerosos procesos químicos y biológicos. Estas reacciones son fundamentales en la producción de energía, fabricación de productos químicos, y procesos biológicos como la respiración celular. Sin estas transformaciones, muchas de las funciones químicas esenciales no podrían realizarse.
Reacciones Redox en Biología
Un ejemplo dominante de la importancia de las reacciones oxidación reducción es la respiración celular. A través de procesos bioquímicos, los organismos utilizan la oxidación de nutrientes para convertir la energía almacenada en enlaces químicos en energía utilizable (ATP) a través de reacciones redox en las mitocondrias.
Aplicaciones de la Oxidación y Reducción en la Vida Cotidiana
Las aplicaciones de la oxidación y reducción son demasiado comunes en nuestra vida diaria. Algunos ejemplos son:
- Conservación de Alimentos: Los antioxidantes agregados a los alimentos impiden la oxidación, prolongando su vida útil.
- Baterías Recargables: Las reacciones redox permiten el almacenamiento de energía en dispositivos electrónicos.
- Tratamiento de Agua: Procesos de oxidación se utilizan para eliminar contaminantes en el agua.
Conclusión: Resumen de las Diferencias entre Oxidación y Reducción
Las diferencias entre oxidación y reducción son fundamentales para entender muchas transformaciones químicas. La oxidación implica la pérdida de electrones con un aumento en el estado de oxidación, mientras que la reducción implica la ganancia de electrones y una disminución en el estado de oxidación. Las reacciones redox son omnipresentes en la química y en la naturaleza, siendo indispensables para procesos biológicos, industrial y ambientales. Entender estos conceptos y ser capaces de identificar oxidacion-reducción ejemplos en la vida cotidiana puede mejorar nuestro conocimiento sobre el mundo que nos rodea, haciendo de la química una disciplina fascinante y relevante.

Entradas relaciondas