Cuáles son las diferencias entre soluto y solvente
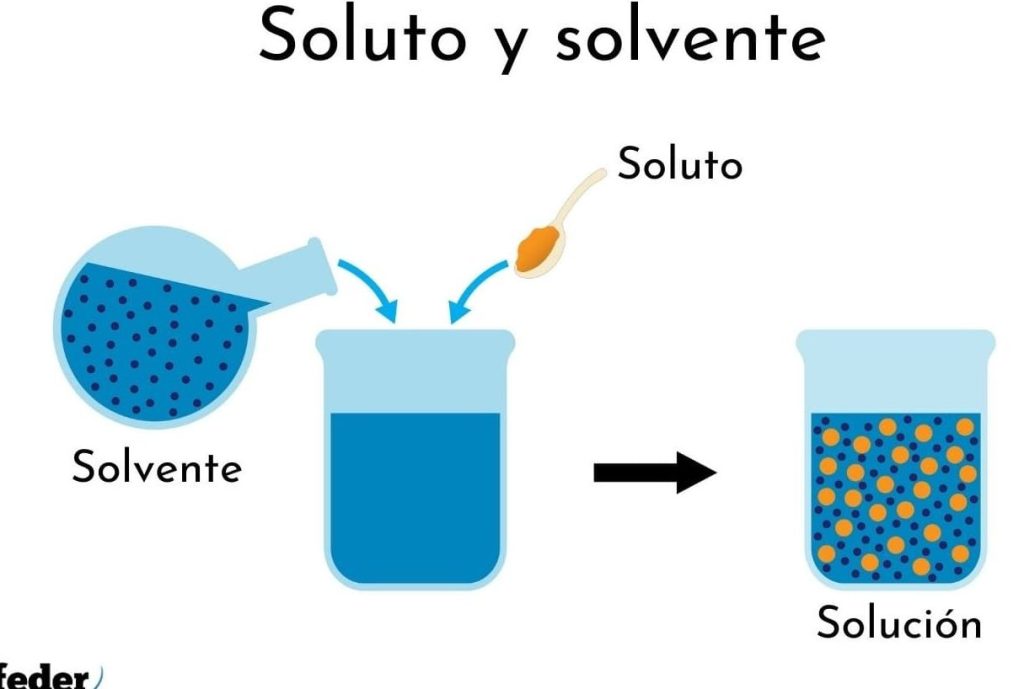
El concepto de soluto y solvente juega un papel fundamental en la química y en la comprensión de las soluciones. Cuando hablamos de química de soluciones, es esencial entender la diferencia entre soluto y solvente, ya que estas dos sustancias interactúan para crear mezclas que pueden tener propiedades únicas y diversas aplicaciones en la vida cotidiana y en la industria. En este artículo, exploraremos a fondo las características de cada uno, así como su relación, diferencias y ejemplos en los que podemos encontrarlos.
La definición de soluto y solvente es básica, pero crucial. Al estudiar disoluciones, nos encontramos con preguntas comunes sobre qué es un soluto y disolvente, cuál es su función y cómo se relacionan. A lo largo de este artículo, abordaremos estas preguntas y ofreceremos una visión completa sobre estos conceptos químicos, además de ilustrar cómo esta comprensión es importante para campos como la farmacología, la alimentación y la ingeniería química.
- Definición de soluto
- Definición de solvente
- Relación entre soluto y solvente
- Diferencias clave entre soluto y solvente
- Ejemplos comunes de solutos y solventes
- Factores que afectan la solubilidad
- Propiedades de las soluciones
- Clasificación de soluciones: diluidas, concentradas y saturadas
- Importancia de entender la diferencia entre soluto y solvente
- Conclusión
Definición de soluto
Un soluto es una sustancia que se disuelve en un solvente para formar una solución. Generalmente, el soluto está presente en menores cantidades en comparación con el solvente. Esto puede涵 incluir sólidos, líquidos o gases que se disuelven en otro medio. La importancia de entender que es el soluto radica en la interacción que tiene con el solvente, lo que determina las propiedades de la solución resultante.
Características del soluto
- Estado de la materia: El soluto puede ser un sólido, un líquido o un gas.
- Proporción: Normalmente, está presente en menor cantidad en la solución.
- Solubilidad: Tiene una capacidad específica para disolverse en un solvente, que puede variar según la temperatura, presión y naturaleza química del soluto.
Definición de solvente
Por otro lado, el solvente es la sustancia que disuelve al soluto en una mezcla, y se encuentra en mayor cantidad. Es común utilizar el agua como solvente, aunque existen muchos otros solventes que son utilizados en diversas aplicaciones. En muchas reacciones químicas, el soluto se disuelve en el solvente, facilitando el contacto y la reacción entre las moléculas.
Características del solvente
- Estado de la materia: Al igual que el soluto, el solvente puede ser un sólido, líquido o gas, aunque la mayoría son líquidos.
- Capacidad de disolución: Un buen solvente debe poseer la capacidad de disolver una variedad de solutos.
- Polaridad: La naturaleza polar o no polar del solvente influye en su habilidad para disolver diferentes tipos de solutos.
Relación entre soluto y solvente
La relación entre un soluto y solvente es fundamental para la formación de una solución. El soluto se dispersa en el solvente, creando una mezcla homogénea que presenta propiedades particulares. Esta relación se puede entender mejor a través del concepto de solubilidad, que es la capacidad de un soluto para disolverse en un solvente a una temperatura y presión determinadas.
Interacción entre solvente y soluto
Cuando se mezclan, las moléculas de solvente rodean a las moléculas de soluto. Esta interacción es crucial para el proceso de disolución, y dependerá de la diferencia entre disolvente y soluto en términos de propiedades físicas y químicas. La solubilidad de un soluto en un solvente particular está afectada por factores como la polaridad y la temperatura.
Diferencias clave entre soluto y solvente
Una de las principales maneras de entender la química de soluciones es a través de las diferencias clave entre soluto y solvente. Hay varias maneras de diferenciar estos dos conceptos químicos:
- Proporción: El soluto está presente en menor cantidad en la solución, mientras que el solvente se presenta en mayor cantidad.
- Rol: El soluto se disuelve; el solvente actúa como el medio en el que esto sucede.
- Ejemplos comunes: Agua es un solvente común, mientras que sal o azúcar suelen ser ejemplos de solutos.
Ejemplos comunes de solutos y solventes
Para ilustrar la diferencia entre el soluto y disolvente, consideremos algunos ejemplos comunes:
- Café: En esta bebida, el café molido actúa como el soluto, mientras que el agua es el solvente.
- Amalgamas dentales: En ellas, el mercurio puede actuar como el solvente, mientras que otros metales como la plata son los solutos.
- Sal en agua: Aquí, la sal es el soluto que se disuelve en el agua, que funciona como el solvente.
Factores que afectan la solubilidad
La solubilidad es fundamental en la relación entre soluto y solvente. Existen varios factores que afectan la capacidad de un soluto para disolverse:
- Temperatura: Para muchos sólidos, la solubilidad aumenta a temperaturas más altas.
- Presión: En el caso de los gases, un aumento en la presión puede aumentar la solubilidad en un solvente.
- Polaridad: La regla “lo similar disuelve a lo similar” se aplica aquí; por lo tanto, solutos polares se disolverán mejor en solventes polares.
Propiedades de las soluciones
Las propiedades de las soluciones son el resultado de la interacción entre el soluto y el solvente. Algunas características a tener en cuenta son:
- Conductividad eléctrica: Las soluciones de electrolitos pueden conducir electricidad debido a la presencia de iones disueltos.
- Punto de ebullición y congelación: Añadir un soluto a un solvente puede elevar el punto de ebullición y reducir el punto de congelación, un fenómeno conocido como propiedades coligativas.
- Viscosidad y densidad: La adición de solutos puede variar la viscosidad y densidad de la solución.
Clasificación de soluciones: diluidas, concentradas y saturadas
Las soluciones pueden clasificarse en diferentes categorías según la cantidad de soluto en relación al solvente:
- Solución diluida: Contiene una pequeña cantidad de soluto en relación con el solvente.
- Solución concentrada: Contiene una gran cantidad de soluto en relación al solvente.
- Solución saturada: Contiene la máxima cantidad de soluto que puede disolverse en el solvente a una temperatura específica, y cualquier soluto adicional no se disolverá.
Importancia de entender la diferencia entre soluto y solvente
Comprender la diferencia entre soluto y solvente es fundamental no solo para los estudiantes de química, sino también para profesionales en campos como la medicina, la ingeniería y la nutrición. Que es el disolvente y el soluto son preguntas comunes que se encuentran en la educación científica sobre la disolución y sus aplicaciones. La capacidad de manipular soluciones puede tener implicaciones en el desarrollo de medicamentos, la preparación de alimentos y muchas reacciones químicas industriales.
Conclusión
La diferencia entre soluto y solvente es una base fundamental en la química que se manifiesta en numerosas aplicaciones prácticas y teóricas. Al conocer qué es el soluto y disolvente, así como su relación y propiedades, no solo comprendemos mejor las soluciones, sino que también podemos aplicarlas de manera efectiva en diferentes contextos. La comprensión de conceptos como la definición de soluto y la diferencia entre disolvente y soluto es clave para abordar problemáticas científicas y técnicas en múltiples disciplinas.

Entradas relaciondas